大批国产仿制药面临出局。
据联邦制药官微消息,该企业的头孢呋辛酯片于8月6日经国家药监局审批,
正式通过仿制药质量和疗效一致性评价。至此,有3家企业通过一致性评价的品种数,增至5个。
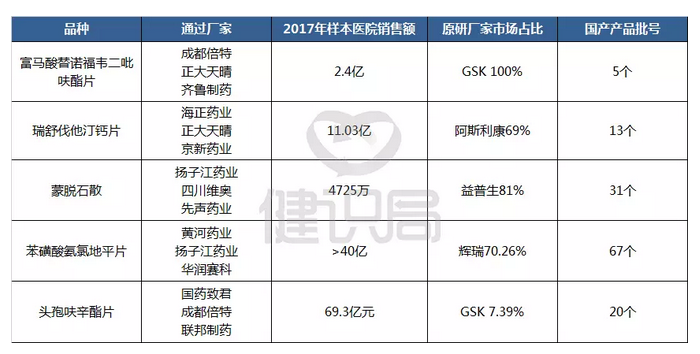
根据国务院关于“同品种药品通过一致性评价的生产企业达到3家以上的,
在药品集中采购等方面不再选用未通过一致性评价的品种”要求,与这5个通过一致性评价生产企业已有3家的品种,
相对应的大批未通过一致性评价仿制药,正面临被踢出市场的命运。
事实上,这种命运已经降临。
此前,江西省药采平台已连发两道通知,
责令包括安徽贝克生物的富马酸替诺福韦二吡呋酯片在内的6个“未通过一致性评价,
且已有其他3家企业通过一致性评价”的药品,暂停挂网,
涉及上述表格中的3个品种——富马酸替诺福韦二吡呋酯片、蒙脱石散、苯磺酸氨氯地平片。
分析人士指出,以此为开端,相关产品将逐渐失去全国各省份市场。
而随着仿制药一致性评价工作的逐步推进,本土仿制药市场的洗牌也将加速。
靴子落地
一周内6产品已暂停采购
这些未通过一致性评价药品,真的被暂停挂网了。
上周五(8月17日),江西省发文,
4家企业——康普药业、浙江京新药业、辅仁药业、北京红林药业的苯磺酸氨氯地平片(5mg)被暂停挂网,
原因是“未通过一致性评价,且已有其他3家企业通过一致性评价”。

一周前(8月10日),江西省药采中心发布通知,
宣布安徽贝克生物的富马酸替诺福韦二吡呋酯片(300mg)、山东仙河药业蒙脱石散(3g)暂停网上采购,
给出的说明是:以上产品未通过一致性评价,且已有其他3家企业通过一致性评价,故暂停其网上采购资格。
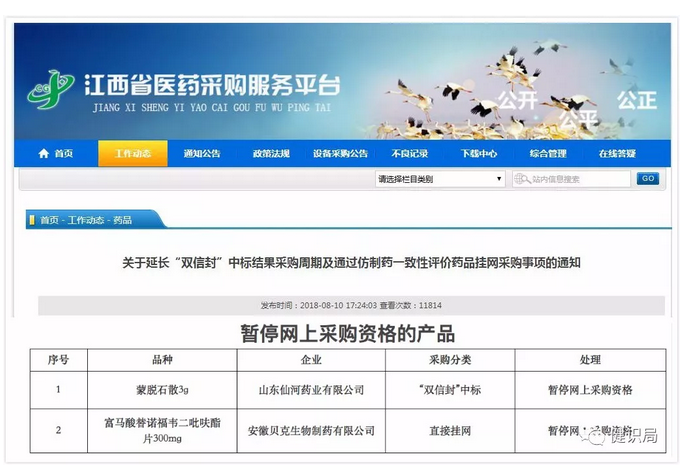
至此,共6家企业的6个产品,被暂停挂网。
这意味着,2016年2月国务院办公厅《关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号)
最后一个鼓励性“承诺”——“通过一致性评价的生产企业达到3家以上的,
在药品集中采购等方面不再选用未通过一致性评价的品种”已兑现。
业界认为,这一政策将为先通过一致性评价品赢得“窗口期”,配合一致性评价品种直接挂网,
国家医保局推出的采购政策等,相关品种数千万,上亿、乃至几十亿市场也将加速洗牌。
除了已经提到的5个通过一致性评价企业已达3家的品种外,
厄贝沙坦氢氯噻嗪片、厄贝沙坦片、草酸艾司西酞普兰片、恩替卡韦分散片、阿托伐他汀钙片与卡托普利片等
品种过一致性评价的生产企业已达两家,须引起相关企业注意。
还观望?
五大利好均已兑现
在上述国办2016年8号文中,为提升我国制药行业整体水平,保障药品安全性和有效性,促进医药产业升级和结构调整,
增强国际竞争能力,鼓励仿制药一致性评价工作开展,国办提出5条利好措施
1、通过一致性评价的药品品种,由食品药品监管总局向社会公布。
2、药品生产企业可在药品说明书、标签中予以标注;开展药品上市许可持有人制度试点区域的企业,可以申报作为该品种药品的上市许可持有人,委托其他药品生产企业生产,并承担上市后的相关法律责任。
3、通过一致性评价的药品品种,在医保支付方面予以适当支持,医疗机构应优先采购并在临床中优先选用。
4、同品种药品通过一致性评价的生产企业达到3家以上的,在药品集中采购等方面不再选用未通过一致性评价的品种。
5、通过一致性评价药品生产企业的技术改造,在符合有关条件的情况下,可以申请中央基建投资、产业基金等资金支持。
但一致性评价成本高,难度大,企业积极性不高。从原国家食药监管总局去年摸底情况看,很多企业仍处于观望状态。
到目前为止,按照8号文要求,须在2018年底前完成一致性评价的“289”目录品种,通过率也不足7%,
且申报情况也不理想。为此,今年5月底,国家食药监管总局药品审评中心(CDE)宣布48个品种可豁免/简化BE。
此举也被视为CDE的无奈之举。
国办“承诺”的兑现情况,也成了影响企业积极性的重要因素。
事实上,去年12月份,第一批通过一致性评价品种公示以来,业界一直关注着,这些政策落实情况。
去年12月至今,国家药监部门已公示5批通过一致性评价品种,涉及57个品规;
视同/通过一致性评价品种也已加标签,并陆续进入“橙皮书”。
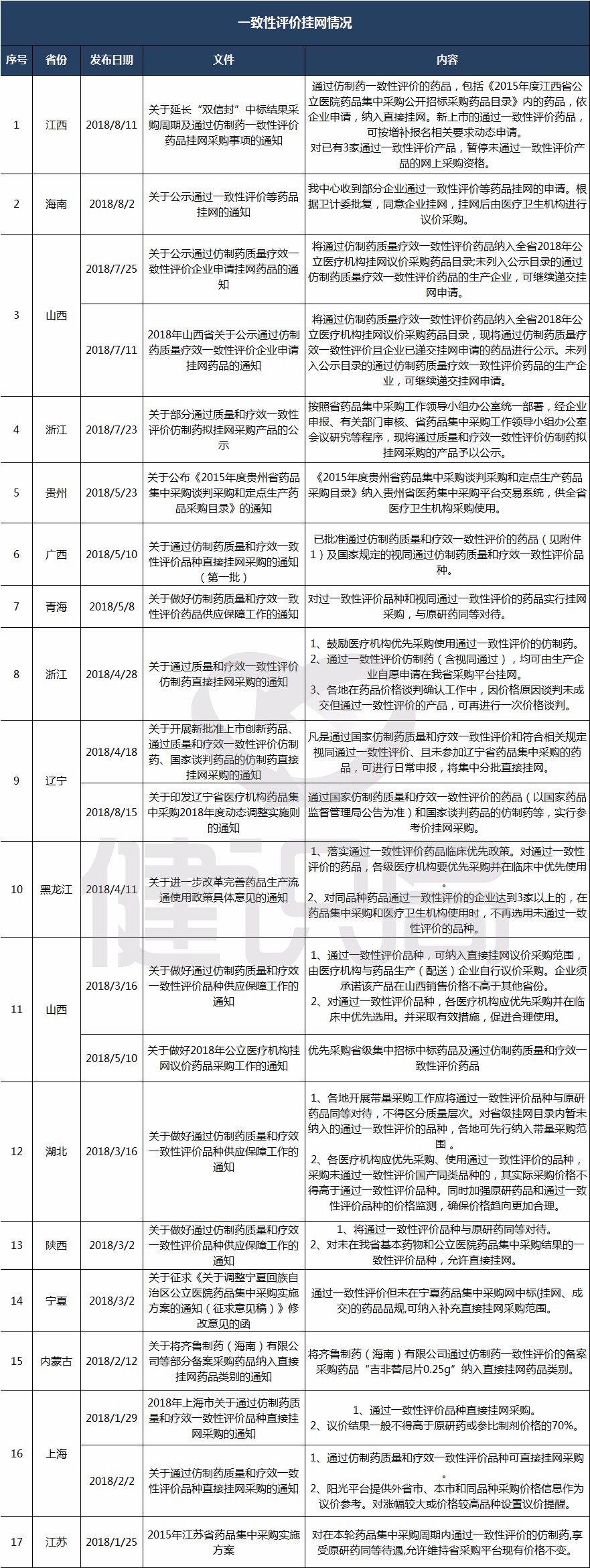
采购环节,至少17省份已落实仿制药一致性评价品种直接挂网政策,并鼓励优先使用一致性评价品种。
在医保方面,今年3月,国办又发布《关于改革完善仿制药供应保障及使用政策的意见》(国办发〔2018〕20号),
赋予通过“一致性”评价的仿制药采购、医生处方、医保支付标准与原研药同等的权利。
8月初,国家医保局组织召开的药品集中采购试点座谈会上,明确落实通过一致性评价品种临床替换原研药,
特别提出“讨论用各省70%的市场份额交换通过一致性评价产品以及原研产品的最低报价,
并此产品的最低报价作为医保的支付价”,从医保和采购两方面支持仿制药一致性评价。
而此次3家以上通过一致性评价,则采购环节不再选用未通过一致性评价品种,
作为最后一个兑现的“承诺”,其落地更具有市场意义,有望彻底打破观望状态,让更多企业下定决心,
积极开展仿制药一致性评价,进而提升生产工艺,提高产品质量。
在利好政策落地的同时,分析人士也提醒相关企业,国办2016年8号文,还有如下要求需引起注意
1、国家基本药物目录(2012年版)中2007年10月1日前批准上市的化学药品仿制药口服固体制剂,应在2018年底前完成一致性评价,其中需开展临床有效性试验和存在特殊情形的品种,应在2021年底前完成一致性评价;逾期未完成的,不予再注册。
2、化学药品新注册分类实施前批准上市的其他仿制药,自首家品种通过一致性评价后,其他药品生产企业的相同品种原则上应在3年内完成一致性评价;逾期未完成的,不予再注册。
| 


